-
购物车共件商品总计:
-
询价列表0共0件商品总计:¥0.00
细胞外囊泡(extracellular vesicles,EVs)是由真核和原核细胞在生理和病理情况下,通过出芽的方式释放出来的,包括外泌体(exosome)、微囊泡和凋亡小体。通常指的细胞外囊泡多指外泌体,直径在40-160nm(平均100nm)左右。近年来,科学家们渐渐揭开了EVs神秘的面纱,发现其在细胞信号传递、免疫应答、药物载体等研究中发挥重要的作用。
自“感染性耐受”的观念提出以来,T细胞一直是研究的重点,其中Treg细胞在外周耐受中担负重要责任,一旦免疫耐受形成,Treg细胞能够转移免疫耐受到一个新的T细胞亚群。Treg细胞分泌的免疫调节性因子TGF-β和IL-10,因强有力的免疫抑制功能而被人们熟知,但是目前没有文献证明它们在非Treg细胞中的免疫调节作用。对于具体导致Treg及非Treg细胞感染耐受的本质,仍旧不完全清楚。 白细胞介素35(IL-35)是Collison团队在2007年发现并命名的抗炎性细胞因子,属于IL-12细胞因子家族的成员,是Ebi3和P35两个亚基组成的二聚体蛋白,在Treg、iTr35(非Treg)和Breg细胞表面稳定表达,在肿瘤、炎症性疾病中发挥免疫抑制作用。最近有文献报道,分泌IL-35的Treg细胞通过外泌体对其他淋巴细胞以一种非特异性感染的方式传递免疫抑制信号,可延长移植物的生存。因此,外泌体依赖性的治疗在感染性耐受如移植耐受中可能会变成一种常见的临床策略。 现在带大家一起解读这篇文章。 参考文献: 1)Jeremy A Sullivan , Yusuke Tomita,etal.Treg-Cell-Derived IL-35-Coated Extracellular Vesicles Promote Infectious Tolerance.Cell Rep.2020 Jan 28;30(4):1039-1051.e5. 2)Jeremy A Sullivan , David P AlAdra,etal.Infectious Tolerance as Seen With 2020 Vision: The Role of IL-35 and Extracellular Vesicles.Front Immunol.2020 Aug 26;11:1867. 3)Minkyung Kang , Jin Kyeong Choi ,etal.Interleukin 35-Producing Exosomes Suppress Neuroinflammation and Autoimmune Uveitis.Front Immunol. 2020 May 29;11:1051. 外泌体研究产品推荐:

该文章首先利用TregEbi3WT C57BL/6小鼠确定Treg细胞在Ebi3 和p35 两个蛋白亚基存在的情况下,能够分泌IL-35。而且,IL-35在耐受特异性Foxp3+和Foxp3neg(iTr35)T细胞表面均有表达。这些细胞比例虽少,但是他们分泌的表达Ebi3和P35的EVs能够靶向20~100倍数量级别的T和B淋巴细胞,使它们也表达IL-35受体,从而也产生免疫耐受。当EVs的产生被抑制或者Treg细胞群Ebi3基因被敲除时,IL-35的表达缺失。说明Treg细胞分泌的EVs可以传递IL-35至周边的淋巴细胞表面,抑制效应性T细胞增殖,同时表达一些免疫抑制性分子如PD-1、TIM3和LAG-3,促使淋巴细胞耗竭。提示Treg细胞分泌的EVs通过传递抑制信号如IL-35,可在移植或自身免疫性等疾病中作为一个治疗的新策略。
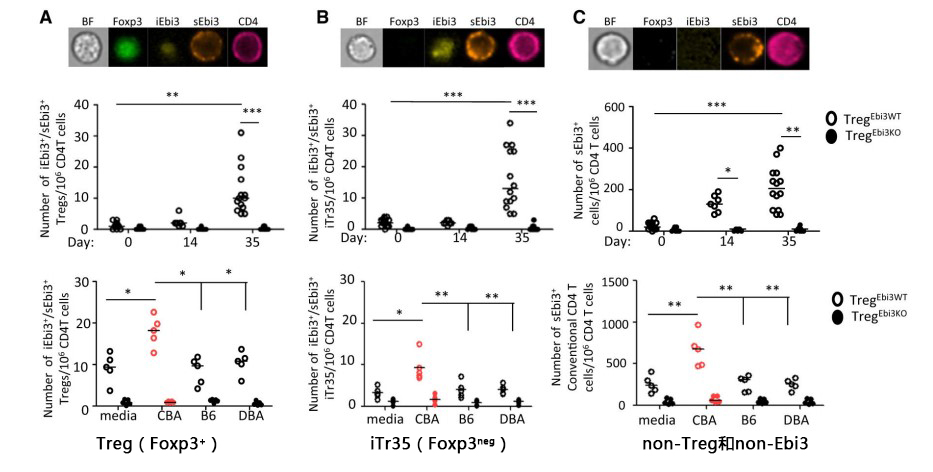
CBA小鼠经免疫耐受处理(供者脾细胞输注+抗CD154抗体处理),分析三组细胞中CD4/Foxp3/Ebi3蛋白的表达情况及CD4+T细胞数。表明同种特异性的Treg和iTr35(Foxp3neg)细胞内源性表达Ebi3(iEbi3)。non-Treg和non-Ebi3 CD4+T细胞缺乏内源性Ebi3(iEbi3)却表达外源性的Ebi3(sEbi3)。在诱导耐受后第35天,表达Ebi3的Treg细胞数显著增加。
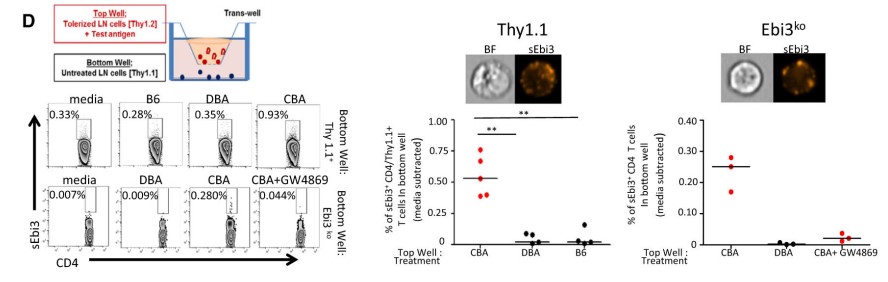
运用Transwell实验(Top Well:CBA耐受小鼠的淋巴结进行CBA抗原再刺激,Bottom Well:敲除Ebi3基因的小鼠淋巴结细胞),过夜培养,发现Ebi3ko+CD4+T细胞数量显著增加,通过在Top Well加入EVs抑制剂GW4869处理细胞,此现象可被逆转。说明高表达sEbi3的non-Treg和non-Ebi3 CD4+T细胞通过EVs从内源性分泌IL-35的Treg和iT35细胞中获得IL-35。
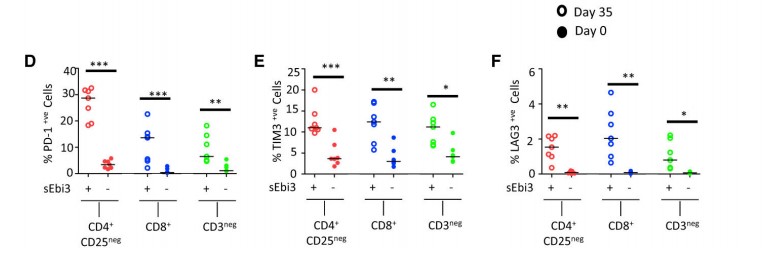
诱导CBA小鼠耐受后第35天,和sEbi3-组相比,sEbi3+组CD4+、CD8+和非T淋巴细胞中表达较高水平的抑制性受体PD-1/TIM3/LAG3。这种情况仅限于EVs修饰的IL-35交叉表达的T和B淋巴细胞中。
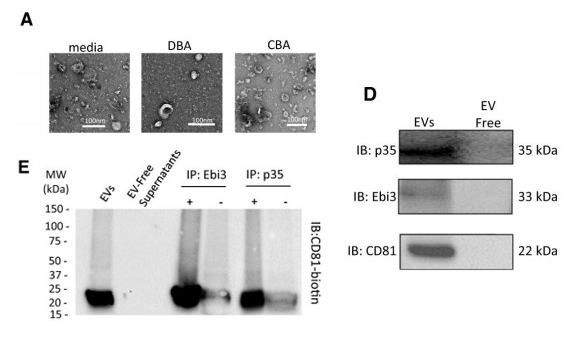
诱导耐受的C57BL/6小鼠淋巴细胞培养上清中分泌的EVs均表达p35和Ebi3蛋白,存在CD81、p35和Ebi3共定位。提示EVs通过表达Ebi3和p35介导IL-35对Treg和iTr35(Foxp3neg)细胞的免疫抑制作用。
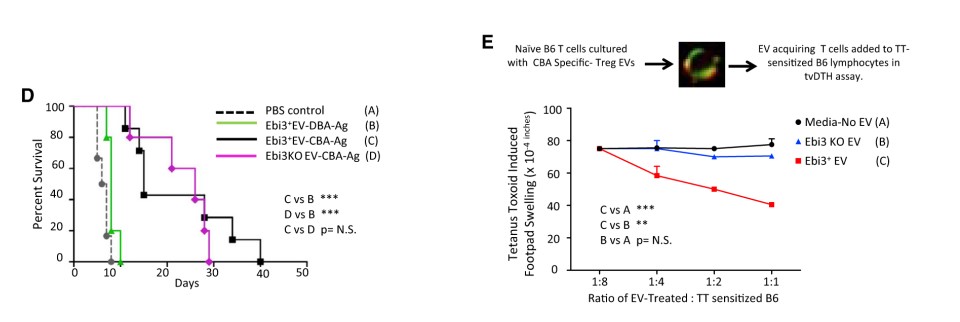
诱导耐受的TregEbi3WT和TregEbi3KO小鼠,于第35天经CBA抗原再刺激,收集上清中的EVs注射到心脏移植的小鼠模型中,可发现心脏移植物的生存期延长。
因此,Treg细胞分泌的EVs通过传递免疫抑制性分子如IL-35至周边淋巴细胞,在感染性耐受中发挥作用,可作为感染性耐受治疗的新策略。
欲了解更多的外泌体研究试剂,请访问http://hansabiomed.eu/或直接联系我们。

HansaBioMed是一家完全致力于外泌体(exosomes)研究工具开发的欧洲公司,可为全球生命科学市场提供最广泛的外泌体研究工具,是历史最悠久也是一家只专注于提供高品质外泌体分离与分析相关产品的公司。目前公司提供的产品主要包括外泌体标准品(Exosome Standards)、外泌体分离(Exosome Isolation)、 外泌体定量分析(Exosome quantification kits)、RNA提取试剂盒(RNA Extraction kits)、DNA提取试剂盒(DNA Extraction kits)、外泌体结合抗体(Exosome binding Antibodies)等。